LE CŒUR ARTIFICIEL
C'est le président américain F.D.Roosevelt, lui-même atteint d'insuffisance cardiaque, qui va débloquer des fonds publics afin d'entamer des recherches sur un possible cœur artificiel. Durant des décennies, plusieurs entreprises se lancent dans la course au cœur artificiel mais aucune ne survit à des projets impossibles à conceptualiser voire franchement loufoques, à base d'alimentation nucléaire... C'est finalement l'entreprise THORATEC qui tire son épingle du jeu car elle est la seule à avoir pensé un projet réalisable.
DEUX TYPES DE CŒUR ARTIFICIEL
Il y a deux grandes catégories de cœur artificiel: les cœurs artificiels orthotopiques et les cœurs artificiels hétéro topiques.
Le cœur orthotopique: ce cœur remplace totalement le cœur biologique. Les chercheurs enlèvent le cœur du patient et le remplacent par un cœur artificiel. C'est l'entreprise CARMAT qui travaille exclusivement sur les cœurs artificiels orthotopiques.
Le cœur hétérotopique: les chercheurs laissent le cœur du patient en place et ajoutent une assistance. Pour les cœurs hétérotopiques il y a deux systèmes de sources d'énergies: pneumatique et électrique. C'est l'entreprise Thoratec qui conçoit ces cœurs artificiels.
Par exemple pour les nouveaux nés qui ont des problèmes de coeur aux premiers instants de leur vie, on va leur installer un cœur artificiel hétérotopiques afin de donner de l'aide au coeur jusqu'à ce que ce dernier puisse assumer son rôle seul.
L'avantage du cœur artificiel hétérotopique de l'entreprise THORATEC est qu'en cas de problème avec le cœur artificiel, le cœur biologique est toujours là en attendant la réparation du coeur artificiel. Tandis qu'avec un cœur orthotopique, si il ne fonctionne plus, le patient décède. ce qui explique les difficultés que rencontre l'entreprise CARMAT lors de leurs essais.
LE CŒUR THORATEC
LE THORATEC PVAD
Voici le cœur artificiel PIVAD (extérieur au corps), ce cœur artificiel possède un système pneumatique qui est relié à une console avec un compresseur qui comprime de l'air avec des valves qui vont envoyer et aspirer l'air.
Dans le cœur il y a une chambre. Lorsqu'on souffle dans le tuyau on compresse la chambre qui est à l'intérieur et donc on éjecte le sang dans le système gauche. Lorsque l'on aspire, la poche se rétracte et le sang est aspiré du système droit. C'est en 1991 que la première implantation a été faite.


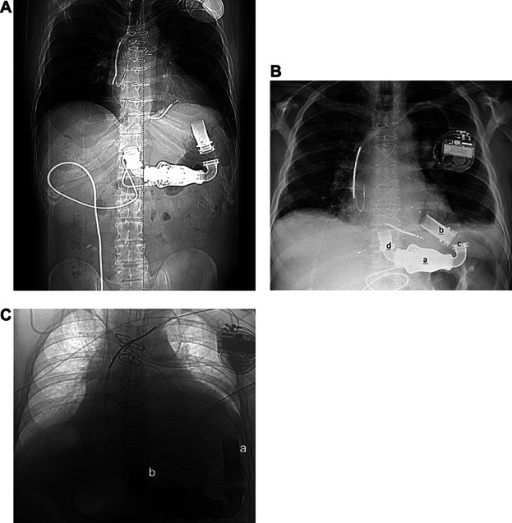
HEARTMATE II LVAS
Ce cœur artificiel est implanté à l'intérieur du corps du patient et nécessite un courant électrique pour fonctionner donc il y a un espèce de chariot qui permet d'alimenter en électricité. A l’intérieur de ce cœur artificiel il y a une sorte de turbine qui permet d'accélérer le sang et de l'éjecter. Au départ c'était une pompe à essence pour la Nasa. A l'intérieur il y a une vrille qui tourne à 15 000 tours par minute. Ce cœur et le plus récent des trois cœurs que je vais vous présenter, la première implantation à lieu en 2005. Il y a juste des fil apparents qui sortent du corps qui permettent de relier l'appareil à une batterie qui se trouve sur un chariot avec un ordinateur également qui va permettent de gérer la vitesse ect. Le système d'assistance ventriculaire gauche (DAVG) Heartmate II a été mis au point dans le but d'offrir un soutien circulatoire à long terme à une vaste gamme de patients atteints d'insuffisance cardiaque avancée. Le Heartmate II est le premier DAVG à débit continu approuvé par la FDA (Food and Drug Administration) pour le pontage jusqu'à la transplantation et le traitement à destination. Plus de 3 000 patients dans le monde ont bénéficié de ses capacités technologiques de pointe, la grande majorité d'entre eux passant des symptômes d'insuffisance cardiaque de classe IV à ceux de classe I ou II.
Aujourd'hui le problème que rencontre les fabricants et ingénieurs est que le cœur artificiel a besoin d'être relié à un chariot afin d'être alimenté. Le patient doit donc vivre avec un chariot à emmener partout avec lui.
THORATEC IVAD
C'est en 1983 qu'a lieu la première implantation. Le boîtier externe du THORATEC IVAD est composé d'un alliage de titane qui fournit une surface lisse pour une pompe implantable à l'intérieur du patient. Le sac de sang interne du THORATEC IVAD est fait du même bio-matériel breveté utilisé dans le THORATEC PVAD. Ce cœur artificiel est composé d'un polymère de base et d'un additif modificateur de surface, offrant une surface hémocompatible supérieure qui permet une durabilité et une flexibilité accrues. Sur la première on peut observer un véritable cœur artificiel à système pneumatique.
Le cœur IVAD THORATEC est le seul dispositif d'assistance ventriculaire implacable pour le soutien ventriculaire gauche, droit ou biventriculaire comme expliqué sur la deuxième image. Ceci va permettre aux patients de retourner vivre chez eux après l'intervention. L'IVAD THORATEC est un dispositif à court et long terme qui est approuvé pour deux indications : Bridge to transplantation ou post craniotomy recovery.
Il a été conçu pour améliorer considérablement la survie et la qualité de vie du patient.
Le cœur THORATEC IVAD a été développé à partir du système thoratec PVAD, fiable et cliniquement performant, qui a été implanté chez plus de 4300 patients dans le monde entier. Utilisé avec le pilote VAD portable TCL-II, le THORATEC IVAD offre aux patients une meilleure qualité de vie, une mobilité accrue et la possibilité de retourner à leur domicile en attendant leur transplantation cardiaque ou leur rétablissement myocardique.


TLC-II PORTABLE VAD DRIVER
Le TLC-II Portable VAD Driver offre aux hôpitaux le premier système mobile capable de soutenir les deux côtés du cœur tout en permettant aux patients d'être renvoyés à la maison en attendant une transplantation cardiaque ou un rétablissement myocardique post-cardiotomie. le TLC-II est un conducteur compact et léger (9,8 kg) qui peut fournir un soutien à court et à long terme, et qui peut fonctionner dans un mode qui ajuste automatiquement le débit des pompes pour répondre aux besoins physiologiques du cœur du patient. Le TLC-II est alimenté par deux batteries rechargeables au lithium-ion ou par une prise électrique.

DUAL DRIVE CONSOLE (DDC)
La console d'entraînement double est conçue pour répondre à la plus large gamme d'exigences en matière de soutien du patient. Avec deux modules indépendants, le DDC est capable de fournir un soutien biventriculaire aux patients stables et instables, où la pression et la dépression doivent être ajustées indépendamment de chaque côté. Conçu pour une utilisation en milieu hospitalier seulement, le DDC est requis dans la salle opératoire après l'implantation soit du THORATEC PVAD soit du THORATEC IVAD.
INTERVENTION CHIRURGICALE, CONVALESCENCE ET RÉADAPTATION
Les médecins recommande l'opération uniquement si celle-ci présente peu de risques. Les patients sont de plus en plus actifs après l'intervention jusqu'à retrouver une vie presque normale. La réadaptation se passe à l'hôpital et elle est très importante pour un mode de vie plus ou moins normal et actif. Cependant les patients ont un rythme de vie légèrement différent après l'intervention. Par exemple, ils vont devoir prendre 6 repas légers par jours afin de répondre aux besoins énergétiques et en protéines.
L'intervention chirurgicale pour implanter un cœur artificiel THORATEC est la même que pour une opération cardiaque. Il y a forcément beaucoup de risques, il existe de nombreux effets indésirables:
Troubles neurologiques comme les AVC
Infections
Hémorragies
Défaillances de l'appareil qui entraînent un remplacement de la pompe
Troubles rénaux et hépatiques
Dépression ou angoisse
ou même Décès du patient
CŒUR CARMAT
Carmat a pour objectif de fournir une solution pérenne à l'insuffisance cardiaque biventriculaire terminale, laquelle est classée dans la catégorie IV du système de la New York Heart Association (NYHA), pour qui la greffe cardiaque reste le seul véritable traitement alternatif. Le cœur CARMAT est dit orthotopique, en effet les chirurgiens ne laissent pas le cœur biologique du patient. On le retire pour implanter le cœur CARMAT.
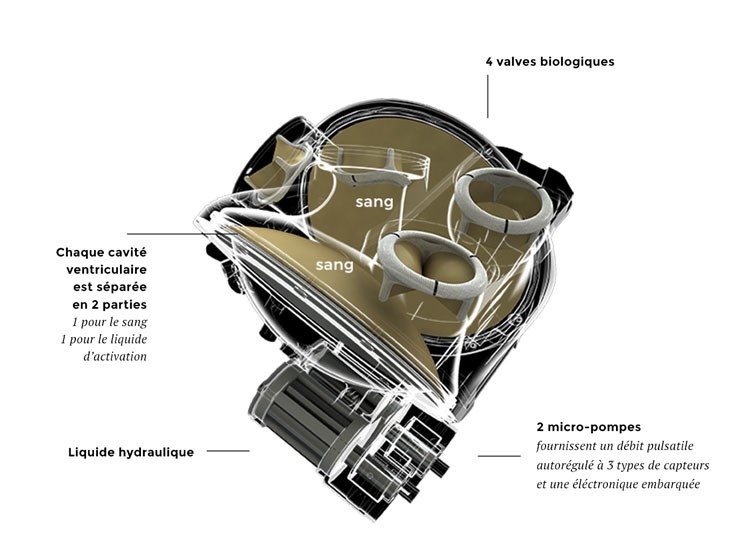
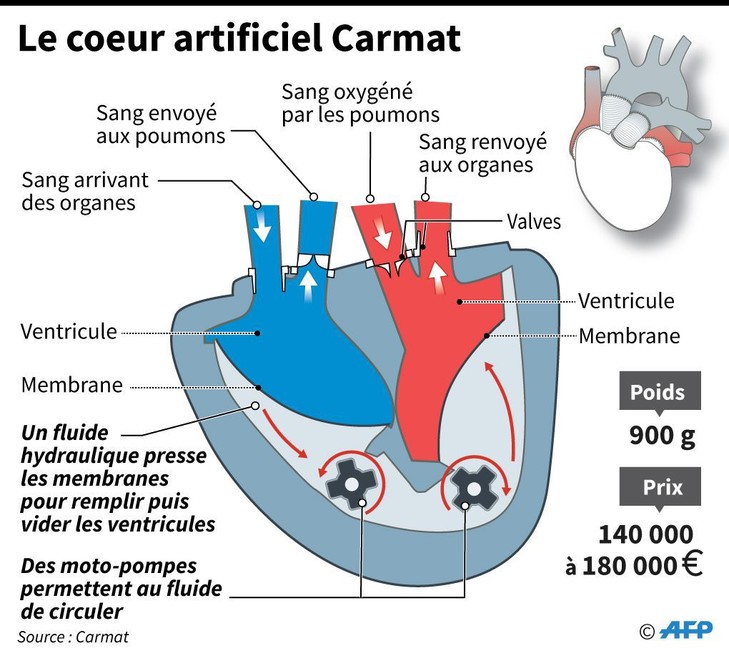
Les recherches de l'entreprise CARMAT se divise en 3 parties:
Il y a d'abord les premiers essais: les premiers essais ont lieu les 19 et 27 juin 1989 à l'hôpital Broussais sur des veaux. Ces premiers essais ne sont pas une franche réussite car les deux veaux ne vont pas survivre à l'opération. La mort de l'un d'eux va cependant permettre aux chercheurs de savoir pourquoi l'opération fut un échec.
Il y dans un second temps les essais cliniques qui étaient initialement prévus fin 2011 mais qui ont débuté en 2013 avec 2 ans de retard. Après avoir requis des résultats complémentaires de tests sur animaux, l'ANSM a finalement approuvé un essai de faisabilité portant sur 4 patients en septembre 2013. Dans un premier temps il y a la première phase de ces essais cliniques dont l'objectif est la survie à 1 mois de ces 4 patients. Le 18 décembre 2013, un premier cœur artificiel est implanté par les équipes des professeurs Christian Latrémouille et Daniel Duveau (CHU Nantes) à l'Hôpital européen Georges-Pompidou à Paris. Le patient décède le dimanche 2 mars 2014, 74 jours après l'implantation, soit au-delà du critère de 30 jours de survie requis par le protocole clinique approuvé par l'ANSM (Agence National de la Sécurité du Médicament. Une deuxième implantation a lieu le 5 août 2014 au CHU de Nantes. Le 19 janvier, on apprend par une déclaration de CARMAT, que le 2e patient qui était un homme de 68 ans atteint d'insuffisance cardiaque terminale était sorti de l'hôpital. Il est décédé le 2 mai 2015 après une survie de 9 mois.
Une deuxième phase pour ces essais cliniques va donc être mis en place. Cette seconde phase consiste en 20 à 25 greffes évaluées selon la survie à 6 mois ainsi qu'à des facteurs qualitatifs. L'autorisation de l'ANSM (Agence Nationale de Sécurité du Médicament et des produits de santé) a été obtenue en juillet 2016. Une première Implantation a lieu au CHU (Centre Hospitalier Universitaire) de Nantes aux alentours du 20 août 2016. Cependant suite au décès du premier patient de cette seconde phase survenu le 12 octobre 2016, l'ANSM suspend cet essai clinique. Puis le 2 mai 2017, l'ANSM autorise la reprise des essais cliniques considérant que la société Carmat a apporté des éléments permettant de reprendre l'essai dans des conditions de sécurité et de maîtrise des risques satisfaisantes. Il y a ensuite une première implantation au Kazakhstan (au National Research Center for Cardiac Surgery, à Astana, par l'équipe du docteur Yuriy Pya) en octobre 2017. Après 8 mois, ce patient a bénéficié d'une transplantation cardiaque (retrait du dispositif Carmat et remplacement par un greffon). Une autre implantation a lieu en Tchèquie probablement en novembre 2017, la date n'a pas été annoncée précisément. Enfin la société Carmat a annoncé le 5 avril 2018 avoir implanté 3 autres patients sans préciser le lieu.
La durée de survie serait supérieure à 1 mois pour les 6 premiers patients de la seconde phase. Ces patients étaient plus jeunes et plus stables que ceux de la première phase. L'objectif est de terminer l'étude fin 2018 pour obtenir le marquage CE. Une nouvelle implantation sur 3 patients a été annoncée sans précisions sur le lieu et la date. Il y a ensuite l'implantation d'un dixième patient qui a été annoncée le 11 juillet. Elle a été réalisée à Prague.
Sur les 10 premiers patients, 7 ont survécu plus de 6 mois avant de mourir et 3 ont bénéficié d'une transplantation cardiaque. Un 11ème patient a été implanté en septembre 2018.
9 implantations sont prévues avant la fin de l'année 2019. L'objectif est d'obtenir le marquage CE avec l'aide de l'organisme de certification DEKRA, en 2020.
L'ambition de l'entreprise CARMAT est que les cœurs artificiels qu'elle fabrique deviennent l'alternative numéro un à une transplantation cardiaque. Les chercheurs se montrent optimistes cependant, l'efficacité reste moindre comparée à celle de THORATEC.
PULSATILITÉ
L'actionnement hydraulique du cœur artificiel CARMAT entraîné par le groupe motopompe reconstitue les deux temps du rythme cardiaque : diastole lors du remplissage des ventricules par le sang et systole lors de l'éjection du sang vers les organes.
AUTO RÉGULATION
Le cœur artificiel CARMAT est le premier cœur artificiel intelligent qui apporte une réponse immédiate et automatique aux besoins métaboliques du patient.
CONCLUSION
Aujourd'hui les chercheurs de THORATEC et de CARMAT travaillent d'arrache-pied pour pouvoir proposer une alternative efficace et sûre aux patients ayant besoin d'une greffe cardiaque. Nous savons à quel point les dons de cœurs sont rares à ce jour et c'est pour cela que ces deux entreprises travaillent sans relâche. THORATEC dans un premier temps a une approche qui semble plus efficace car ses cœurs artificiels permettent aux patients de retrouver une vie active et presque normale. Cependant ils ne sont pas un remplacement complet du cœur: ils s'avèrent efficaces et présentent moins de danger que le cœur CARMAT mais ils fournissent seulement une assistance à ce dernier.

